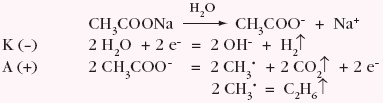Jest to całokształt zjawisk (szereg reakcji utleniania - redukcji) wywołanych przepływem stałego prądu elektrycznego przez roztwory elektrolitów lub ich formę stopioną.
Elektroliza jest procesem wymuszonym przyłożonym z zewnątrz napięciem. Najniższe napięcie zewnętrznego źródła prądu stałego potrzebne do wywołania reakcji elektrodowej to napięcie rozkładowe. Jest ono równe co najmniej sile elektromotorycznej ogniwa, w którym zachodzi samorzutnie analogiczna reakcja, ale w kierunku przeciwnym.
Elektrody:
- anoda (połączona z dodatnim biegunem źródła prądu) – zachodzi utlenianie jonów ujemnych migrujących do anody,
- katoda (połączona z ujemnym biegunem źródła prądu) – zachodzi redukcja jonów dodatnich migrujących do katody.
Najczęściej elektrody są platynowe lub grafitowe (elektrody obojętne), czasem również np. miedziane.
Skutkiem przepływu prądu przez elektrolit jest:
- uporządkowany ruch jonów w roztworze,
- przebieg procesów chemicznych na powierzchniach elektrod,
- prawie zawsze zmiany stężenia w obszarach elektrolitu sąsiadujących z elektrodami.
Zakładając, że elektrolizę prowadzi się używając elektrod obojętnych (platyna, grafit) i poddano jej wodne roztwory elektrolitów, możliwe procesy elektrodowe przedstawiono poniżej:
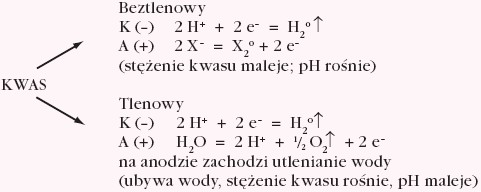
Aniony kwasów tlenowych w roztworach wodnych w założonych warunkach nie ulegają utlenianiu – utleniają się cząsteczki wody.

SOLE (zgodnie z regułami omówionymi powyżej dotyczącymi kationu metalu i anionu reszty kwasowej):
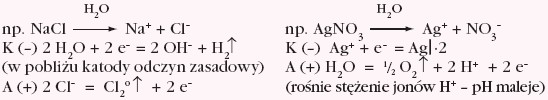
Jeżeli anoda wykonana jest np. z miedzi, to należy dodatkowo uwzględnić proces jej anodowego roztwarzania, np. podczas elektrolizy roztworu wodnego CuSO4 na elektrodach miedzianych:
Cu → Cu2+ + 2 e– anoda miedziana utlenia się
Jeżeli katoda wykonana jest np. z rtęci, to w tych warunkach wszystkie metale ulegają redukcji na katodzie.
Jeżeli elektrolizie poddano stopione elektrolity (np. tlenki, wodorotlenki,sole), to w tych warunkach wszystkie metale ulegają redukcji na katodzie.
Produkty elektrolizy stopionego chlorku sodu:
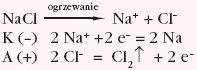
Produkty elektrolizy roztworu wodnego octanu sodu: