Elektroliza – całokształt zjawisk (szereg reakcji utleniania-redukcji), wywołanych przepływem stałego prądu elektrycznego przez roztwory elektrolitów lub formę stopioną substancji.
Aby przeprowadzić elektrolizę potrzebne są:
- źródło prądu stałego,
- elektrody zanurzone w elektrolicie,
- woltomierz lub amperomierz,
- opornik do regulowania różnicy potencjałów między elektrodami,
- elektrolizer wraz z elektrolitem.
Elektroliza jest procesem wymuszonym przez przyłożone z zewnątrz napięcie. Najniższe napięcie zewnętrznego źródła prądu stałego potrzebne do wywołania reakcji elektrodowej to napięcie rozkładowe. Jest ono równe co najmniej sile elektromotorycznej ogniwa, w którym zachodzi samorzutnie analogiczna reakcja chemiczna, ale w kierunku przeciwnym.
Skutkiem przepływu prądu przez elektrolit jest:
- uporządkowany ruch jonów w roztworze,
- przebieg procesów chemicznych na powierzchniach elektrod,
- zmiana stężenia w obszarach elektrolitu sąsiadujących z elektrodami.
Pamiętaj! Podczas elektrolizy roztworu wodnego zawierającego:
- kilka kationów ⇒ jako pierwszy redukuje się kation o najwyższym potencjale standardowym, następnie kolejno kationy o coraz niższych potencjałach,
- kilka anionów ⇒ jako pierwszy utlenia się anion o najniższym potencjale standardowym, a w następnej kolejności będą się utleniać aniony o coraz wyższym potencjale.
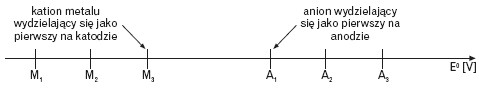
Im bardziej szlachetny metal, tym łatwiej ulega redukcji.

