Układ utworzony przez połączenie dwóch półogniw za pomocą klucza elektrolitycznego nosi nazwę ogniwa galwanicznego. W ogniwie elektrody połączone są ze sobą przewodnikiem metalicznym, który pełni rolę przekaźnika elektronów, a roztwory – kluczem elektrolitycznym, który umożliwia przepływ niewielkiej liczby jonów, wyrównujący bilans ładunku. Zamknięcie obwodu np. amperomierzem lub woltomierzem spowoduje, że ich wskazówka wychyli się, co wskazuje, że w układzie płynie prąd. Źródłem prądu elektrycznego w ogniwie jest samorzutny przebieg reakcji utleniania-redukcji.
W ogniwie są dwa półogniwa/elektrody, np. metaliczne:
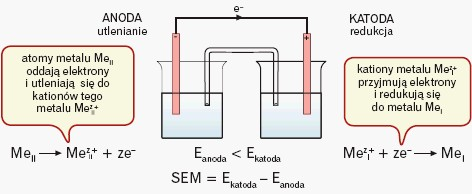
- na jednej następuje wydzielanie metalu, czyli zachodzi redukcja; jest to katoda:
![]()
- na drugiej jony metalu przechodzą do roztworu, czyli zachodzi utlenianie; jest to anoda:
![]()
Elektroda o niższej wartości potencjału jest anodą, a o wyższej wartości – katodą. Katoda ma znak dodatni, a anoda ujemny. Elektrony płyną od anody do katody; umownie przyjęto, że prąd przepływa w kierunku odwrotnym:
![]()
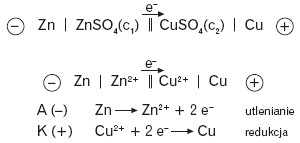
Schematyczny zapis ogniwa zgodnie z konwencją sztokholmską:

Sumaryczną reakcję zachodzącą w ogniwie można przedstawić następującym wzorem:
![]()
Siła elektromotoryczna (SEM) powstałego ogniwa będzie równa różnicy potencjałów elektrod (od potencjału katody odejmuje się potencjał anody) w ogniwie niepracującym.
![]()
Poniżej przedstawiono budowę ogniwa metalicznego.
Przykładowym ogniwem jest tzw. ogniwo Daniella:
Co się dzieje podczas pracy ogniwa?
- na płytce cynkowej gromadzą się elektrony, które przez przewodnik płyną do elektrody miedziowej – atomy cynku przechodzą do roztworu w postaci kationów (elektroda cynkowa roztwarza się),
- elektroda miedziowa oddaje płynące do niej przez przewód (od elektrody cynkowej) elektrony jonom miedzi znajdującym się w sąsiedztwie elektrody. Na tej elektrodzie osadza się metaliczna miedź.
Procesy zachodzące w czasie pracy ogniwa Daniella można przedstawić w sposób uproszczony (bez zachowania relacji między wielkościami jonów i atomów) na poniższym schemacie:
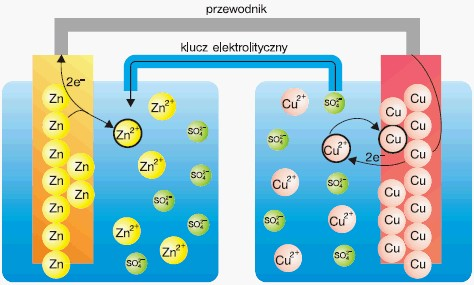
W ogniwie Daniella na anodzie zachodzi utlenianie cynku. Jony Zn2+ przechodzą do roztworu, natomiast elektrony wędrują do katody, na której zachodzi redukcja jonów Cu2+. Przez klucz elektrolityczny wędrują jony przeciwnego znaku w celu wyrównania powstającej różnicy ładunków. Sumarycznie procesy zachodzące w ogniwie można przedstawić równaniem:
![]()
Warto zauważyć, że jeśli do roztworu przechodzi 65 g jonów cynku (1 mol) to na miedzianej blaszce osadza się 63,5 g (1 mol) atomów miedzi. Masa blaszki cynkowej maleje o 65 g, natomiast masa blaszki miedzianej wzrasta w tym samym czasie o 63,5 g. Blaszka cynkowa roztwarza się, natomiast na blaszce miedziowej osadza się miedź. Ogniwo pracuje, czyli prąd płynie, dopóki nie nastąpi całkowite roztworzenie płytki cynkowej (wszystkie atomy cynku obecne w płytce utlenią się) lub redukcja wszystkich kationów miedzi Cu2+ obecnych w roztworze.
Inaczej wyglądają procesy zachodzące w ogniwach redoks oraz w ogniwach stężeniowych:
- Przykład ogniwa stężeniowego:
![]()
Ta różnica stężeń powoduje wyraźną różnicę potencjałów elektrod i stąd anodą i katodą są odpowiednio:
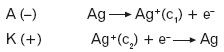
Sumaryczna reakcja zachodząca w ogniwie to:
![]()
Ogniwo pracuje do momentu wyrównania stężeń roztworów.
![]()
- Przykład ogniwa redoksowego:
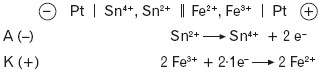
Sumaryczna reakcja zachodząca w ogniwie:
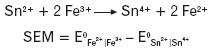
Znajomość wartości potencjałów standardowych półogniw różnego rodzaju pozwalana przewidywanie:
- czy dana reakcja utlenienia-redukcji zajdzie w rzeczywistości,
- kierunku reakcji chemicznej.
Istnieje prosta reguła: reakcja chemiczna zachodzi tylko wtedy, gdy:
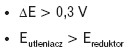
Pamiętaj! Im większa różnica potencjałów standardowych, tym bardziej prawdopodobna jest dana reakcja chemiczna.
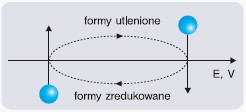
Do ustalania substratów reakcji chemicznej może posłużyć tzw. metoda zegara:
- na osi potencjału zaznacz wartości i w tym miejscu przeprowadź proste prostopadłe do osi E,
- nad osią wpisz odpowiednie formy utlenione, a pod osią – zredukowane,
- kierunek reakcji wyznaczą strzałki zorientowane zgodnie ze wskazówkami zegara,
- substraty rzeczywistej reakcji są oznaczone jako
 .
.