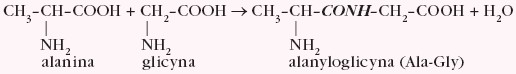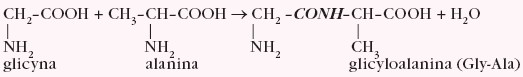Aminokwasy to związki dwufunkcyjne zawierające w swych cząsteczkach grupę karboksylową –COOH oraz grupę aminową –NH2. Często stosowaną zasadą określającą wzajemne położenie grupy aminowej i karboksylowej jest oznaczenie atomów węgla w łańcuchu węglowodorowym kolejnymi literami greckimi: α, β, γ, δ.
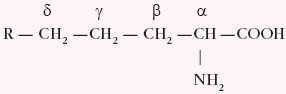
Biorąc pod uwagę różne kryteria podziału można dokonać ich rozmaitej klasyfikacji. Aminokwasy dzielimy na:
- białkowe i niebiałkowe,
- glikogenne i ketogenne,
- α-aminokwasy i o nietypowej budowie,
- egzogenne i endogenne,
- alifatyczne, aromatyczne i heterocykliczne,
- niepolarne i polarne,
- kwasowe, zasadowe i obojętne (zawierające niepolarne łańcuchy boczne lub polarne łańcuchy boczne z grupami funkcyjnymi niedysocjującymi).
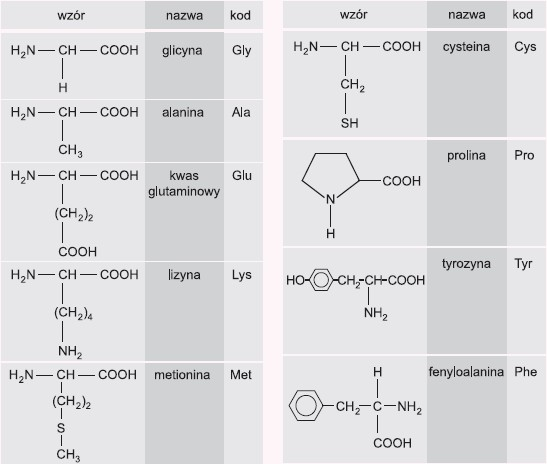
Poniżej podano wzory i nazwy przykładowych aminokwasów białkowych. Przy każdym z nich znajduje się również ich trzyliterowy skrót.
Wszystkie aminokwasy białkowe w organizmie ludzkim są α-L-aminokwasami. Wyjątkiem jest glicyna, która nie tworzy izomerów optycznych (brak asymetrycznego atomu węgla w cząsteczce). Aminokwasy białkowe są więc optycznie czynne. Do ustalenia ich przynależności do szeregu L jako wzorzec wybrano L-serynę.
Aminokwasy są ciałami stałymi, krystalicznymi o dość wysokiej temperaturze topnienia. W stanie stałym aminokwasy występują w postaci soli wewnętrznych, które zawierają tzw. jony obojnacze, np.
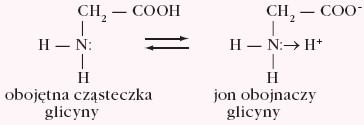
W wodnym roztworze aminokwasów zawierających jedną grupę karboksylową i jedną grupę aminową ustala się stan równowagi, w którym występują trzy formy jonowe:
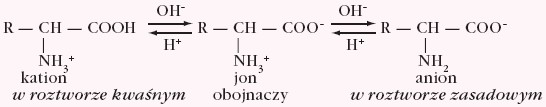
W roztworze kwaśnym, przy małej wartości pH, występuje kation, a w roztworze zasadowym, przy dużej wartości pH, występuje anion. Wartość pH roztworu, przy której istnieje dokładna równowaga między formą kationową i anionową, i stężenie jonu obojnaczego jest największe, nosi nazwę punktu izoelektrycznego (pI). Zmiana pH roztworu wywołuje przesunięcie równowagi w stronę anionu (pH > pI) lub w stronę kationu (pH < pI). W punkcie izoelektrycznym aminokwas wykazuje minimum rozpuszczalności, lepkości oraz ruchliwości w polu elektrycznym, gdyż stężenie anionowej i kationowej formy jest minimalne i równe sobie.
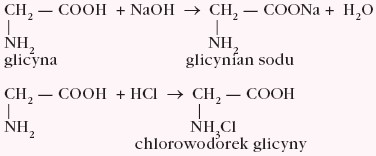
Ze względu na obecność w cząsteczce grupy funkcyjnej o właściwościach kwasowych (–COOH), jak i zasadowych (–NH2),aminokwas reaguje jak związek amfoteryczny, np.
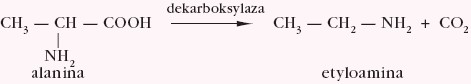
Aminokwasy ulegają dekarboksylacji. Pod wpływem enzymu dekarboksylazy tworzy się tlenek węgla(IV) i odpowiednia amina I-rzędowa, np.:
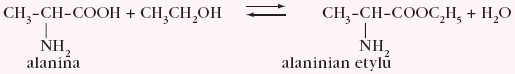
Aminokwasy reagują z kwasami tworząc estry, np.
Dodatkowo wszystkie α–aminokwasy pod wpływem kwasu azotowego(III) ulegają dezaminacji, tworząc odpowiednio α–hydroksykwas i azot, np.
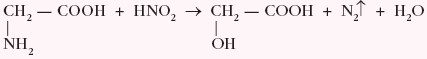
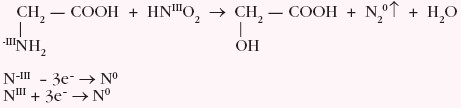
Reakcja ta nosi nazwę reakcji van Slyke’a i pozwala na ilościowe oznaczenie aminokwasu w układzie. Reakcja ta jest przykładem synproporcjonowania:
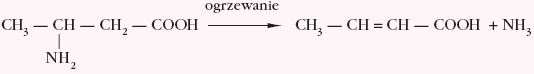
Charakterystyczną właściwością β–aminokwasów jest tworzenieα, β-nienasyconych kwasów na drodze eliminacji cząsteczki amoniaku, np.
Z kolei γ,δ–aminokwasy ulegają cyklizacji tworząc laktamy, czyli cykliczne amidy (odpowiednie oddalenie grup funkcyjnych warunkuje wewnątrzcząsteczkową kondensację), np.
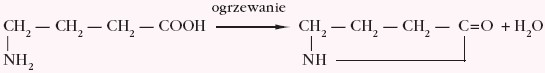
Szczególna właściwość aminokwasów wiąże się ze zdolnością ich cząsteczek do łączenia się z sobą w większe ugrupowania. W reakcji kondensacji cząsteczki glicyny i alaniny można uzyskać dipeptydy, np.