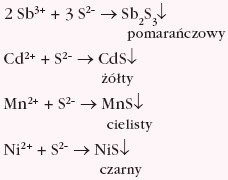Siarka jest niemetalem występującym w przyrodzie w stanie wolnym (siarka rodzima), jaki w postaci różnych związków chemicznych (minerały: ZnS – blenda cynkowa, PbS – galena, FeS2 – piryt, CaSO4 – anhydryt).
Siarka jest niemetalem występującym w przyrodzie w stanie wolnym (siarka rodzima), jaki w postaci różnych związków chemicznych (minerały: ZnS – blenda cynkowa, PbS – galena, FeS2 – piryt, CaSO4 – anhydryt).
Konfiguracja elektronowa atomu siarki: 1s22s22p63s23p4.
Stopnie utlenienia siarki w związkach: –II, IV, VI.
Siarka jest kruchą substancją krystaliczną o żółtej barwie.
Siarka w temperaturze pokojowej występuje w dwóch odmianach alotropowych: siarka rombowa i siarka jednoskośna. Odmiany te różnią się budową wewnętrzną.
Siarka w postaci stopionej tworzy szereg odmian: żółta ruchliwa ciecz, brunatna gęsta ciecz, ruchliwa ciecz. Gwałtownie schłodzona tworzy siarkę plastyczną.
Po ogrzaniu siarka pali się niebieskim płomieniem, a wydzielający się gaz ma nieprzyjemną duszącą woń – tlenek siarki(IV)
S + O2 → SO2
Gaz ten reaguje z wodą tworząc słaby kwas siarkowy(IV)
SO2 + H2O → H2SO3
Utlenianie tlenku siarki(IV) w obecności katalizatora (V2O5 lub Pt) pozwala na otrzymanie tlenku siarki(VI). Ta biała substancja stała energicznie reaguje z wodą tworząc kwas siarkowy(VI):
2 SO2 + O2 → 2 SO3
SO3 + H2O → H2SO
Stężony kwas siarkowy(VI) jest bezbarwną, gęstą, oleistą, silnie żrącą cieczą o właściwościach higroskopijnych. Zaliczany jest do kwasów silnie utleniających: utlenia nie tylko metale, ale i niemetale:
Hg + 2 H2SO4 → HgSO4 + SO2 + 2 H2O
C + 2 H2SO4 → CO2 + 2 SO2 + 2 H2O
Pod wpływem stężonego kwasu siarkowego(VI) niektóre metale, np. żelazo, ołów, ulegają pasywacji.
Reakcją charakterystyczną na wykrycie jonów SO42– w roztworze jest reakcja z jonami Ba2+:
Ba2+ + SO42– → BaSO4↓
Siarkowodór to gaz o nieprzyjemnym zapachu zgniłych jaj. Jest trujący. Siarkowodór rozpuszczając się w wodzie tworzy kwas siarkowodorowy, który zaliczany jest do słabych kwasów.
Siarkowodór otrzymujemy w reakcjach:
- bezpośredniej syntezy:
H2 + S → H2S - działając mocnymi kwasami na określone związki:
Na2S + H2SO4 → Na2SO4 + H2S
Większość siarczków metali to osady o charakterystycznych barwach. Strącanie osadów siarczków można traktować jako reakcję charakterystyczną dla jonów metali: