
poleca
b/d
Teoria jonowa Arrheniusa
Kwas: związek, który w roztworach wodnych dysocjuje na kationy wodoru H + i anion reszty kwasowej Zasada: związek, który w roztworach wodnych dysocjuje na kation metalu i aniony wodorotlenkowe OH –
poleca
34%
21 głosów
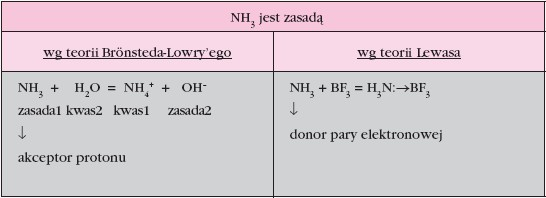
Teoria protolityczna Brönsteda-Lowry’ego
Kwas: protonodawca, czyli substancja (cząsteczka, jon) zdolna do oddawania protonu, np.HCl, H 2 O, CH 3 COOH, H 3 O + , NH 4 + , HSO 4 – , HCO 3 – Zasada: protonobiorca, czyli substancja (cząsteczka, jon) zdolna do pobierania protonu, np.NH 3 , CH 3 NH 2 , H2O, CH 3 COO – , CO 3 2– Sprzężone pary kwas – zasada: kwas = zasada + proton transfer protonu Im mocniejszy kwas, tym słabsza sprzężona z nim zasada. H 2 O + H 2 O = H 3 O + + OH – NH 3 + NH 3 = NH 4 + + NH 2 – H 2...
poleca
47%
13 głosów
Teoria elektronowa Lewisa
Kwas to atom, cząsteczka lub jon przyjmujący parę elektronową (akceptor), czyli kwas ma właściwości elektronoakceptorowe: BF 3 , H + ,Cu 2 + (np. niecałkowicie zapełniona powłoka zewnętrzna). Zasada to atom, cząsteczka lub jon dostarczający parę elektronową (donor), czyli zasada ma właściwości elektronodonorowe (ma wolną parę elektronową): H 2 O, NH 3 , Cl – , CN – . W tym przypadku reakcja pomiędzy kwasem i zasadą jest reakcją, w której powstaje wiązanie koordynacyjne, czyli odbywa...
Podobne teksty:
Materiał opracowany przez eksperta
Spis treści
-
Teorie kwasów i zasad
Teorie kwasów i zasad

