Niezależnie od tego, czy reakcja chemiczna przebiega od stanu początkowego do stanu końcowego bezpośrednio czy przez reakcje pośrednie, całkowity efekt cieplny reakcji jest w obu przypadkach taki sam. Założono, że wszystkie procesy muszą zachodzić w ustalonych warunkach izotermiczno-izobarycznych lub izotermiczno-izochorycznych.
Efekty cieplne reakcji można obliczyć korzystając z prawa Lavoisiera-Laplace’a oraz prawa Hessa. Prawa te wykorzystuje się do wyznaczenia nieznanych efektów cieplnych reakcji chemicznych na podstawie innych reakcji, dla których znane są efekty cieplne. W obliczeniach można również wykorzystać stabelaryzowane wartości standardowych molowych entalpii tworzenia lub standardowych molowych entalpii spalania (dla substancji organicznych) oraz – w przypadku gdy wszystkie substancje są gazami – energii wiązań chemicznych zgodnie z poniższymi wzorami:
- ΔH0 reakcji = Σ (ni ΔH0tw) produkty – Σ (ni ΔH0tw) substraty
- ΔH0 reakcji = Σ (ni ΔH0sp) substraty – Σ (ni ΔH0sp) produkty
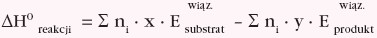
Σ (sigma) – symbol sumy (dodawania) określonych składników,
ni – współczynniki stechiometryczne występujące w równaniu termochemicznym,
x – liczba wiązań danego typu w cząsteczce substratu,
y – liczba wiązań danego typu w cząsteczce produktu,
Ewiąz.– energia wiązania chemicznego, czyli energia potrzebna do rozerwania wiązania, i tym samym energia uwalniania przy jego tworzeniu.

