Aminokwasy są ciałami stałymi, krystalicznymi o dość wysokiej temperaturze topnienia; dobrze rozpuszczają się w wodzie, a słabo w polarnych rozpuszczalnikach organicznych.
W stanie stałym aminokwasy występują w postaci soli wewnętrznych. Są to tzw. jony obojnacze.
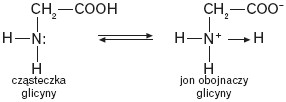
W wodnym roztworze aminokwasów zawierających w cząsteczce jedną grupę karboksylową i jedną grupę aminową ustala się stan równowagi, w którym występują trzy formy jonowe:
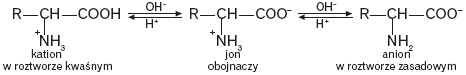
Wartość pH roztworu, przy której istnieje dokładna równowaga między formą kationową i anionową (stężenie kationowej i anionowej formy jest minimalne i równe sobie) i stężenie jonu obojnaczego jest największe, nosi nazwę punktu izoelektrycznego (pI). Zmiana pH roztworu (alkalizacja lub zakwaszenie roztworu) wywołuje przesunięcie równowagi w stronę anionu (pH > pI) lub w stronę kationu (pH < pI).
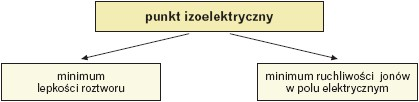
Zmiana wartości pH roztworu wodnego zmienia ładunek całkowity formy aminokwasu, a tym samym determinuje jego zachowanie np. w polu elektrycznym.
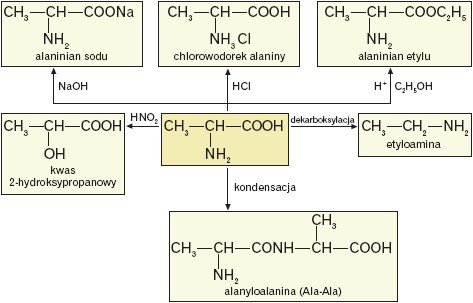
Ze względu na obecność w cząsteczce grupy funkcyjnej o właściwościach kwasowych(–COOH), jak i zasadowych (–NH2), aminokwasy reagują zarówno z zasadami, jak i kwasami, np.:
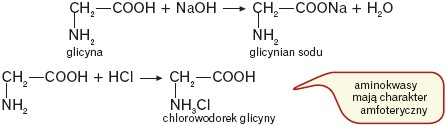
Ze względu na obecność w cząsteczce aminokwasu grupy karboksylowej, która zachowuje swoje właściwości:
- aminokwasy ulegają dekarboksylacji; pod wpływem enzymu dekarboksylazy tworzy się tlenek węgla(IV) i odpowiednia amina I-rzędowa, np.:

Aminy powstające w tym procesie to tzw. aminy biogenne o silnym działaniu fizjologicznym.
- aminokwasy reagują z alkoholami tworząc estry, np.:
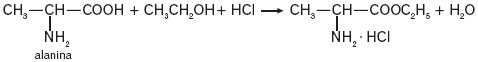
Reakcję prowadzi się w podwyższonej temperaturze i w obecności kwasu nieorganicznego, np. HCl. Powstający chlorowodorek aminoestru w reakcji z mocną zasadą utworzy aminoester.
- aminokwasy w reakcji z aldehydami aromatycznymi tworzą tzw. zasady Schiffa:
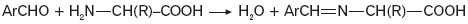
Poniżej przedstawiono schemat reakcji, w których alanina stanowi substrat.