Energia wyzwolona w przemianach egzoergicznych jest wykorzystywana do przeprowadzenia przemian endoergicznych. Przekazanie energii wymaga jej zmagazynowania, które odbywa się za pośrednictwem przenośników energii. Związki te posiadają wiązania wysokoenergetyczne, umożliwiające przyłączenie łatwych do przenoszenia grup chemicznych (głównie fosforanowych, np. w ATP, fosfokreatynie,ale też w grupie -SH, jak w acetylo-CoA), a także elektronów o wysokiej energii (przenoszonych np. przez NADH, NADPH, FADH2). Wytworzenie wiązania wysokoenergetycznego wymaga dużych nakładów energii (powyżej 20 kJ/mol), ale jego rozkład uwalnia tę energię z powrotem. Przyłączenie reszty fosforanowej do ADP w celu syntezy ATP odbywa się na drodze fosforylacji substratowej, oksydacyjnej i fotosyntetycznej.
Sprzężenie reakcji egzoergicznych z endoergicznymi wymaga również obecności enzymów, które zwiększają szybkość reakcji biochemicznych, obniżając równocześnie energię aktywacji reagujących substancji. Enzymy są katalizatorami reakcji chemicznych w żywym organizmie. Większość enzymów to białka proste lub złożone. W złożonych część białkową stanowi apoenzym, a część niebiałkową grupa prostetyczna (gdy połączona jest nietrwale z enzymem, nosi nazwę koenzymu). Istotną częścią enzymu jest obszar zwany centrum aktywnym, który ma postać wgłębienia o ściśle określonej konformacji przestrzennej, zawierającej odpowiednie aminokwasy. Umożliwia to związanie cząsteczki ściśle określonego substratu i grupy prostetycznej (jeśli istnieje).
Pierwszym etapem katalizy enzymatycznej jest utworzenie kompleksu enzym-substrat. Pozwala to obniżyć energię aktywacji katalizowanej przez enzym reakcji, dzięki czemu następuje przemiana substratu w produkt. Ostatnim etapem reakcji jest oddzielenie się enzymu od produktu.
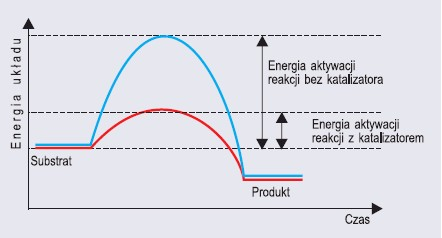
Wykres energii obrazujący zasadę działania enzymu jako katalizatora
Szybkość reakcji enzymatycznej zależy od rodzaju reakcji, typu enzymu oraz jego aktywności, stężenia substratów i produktów, natomiast kontrola aktywności enzymu odbywa się poprzez czynniki ustrojowe (temperatura, pH), wpływ na transkrypcję i translację, regulację aktywności enzymu na drodze hamowania przez sprzężenie zwrotne (nagromadzenie produktu reakcji powoduje jej zahamowanie), wytwarzania proenzymów za pośrednictwem białek regulatorowych oraz innych substancji o charakterze aktywatorów lub inhibitorów.
Koenzymami enzymów są m.in.: niektóre witaminy z grupy B lub ich pochodne, zmodyfikowane nukleotydy zawierające prekursory witamin z grupy B (np. FAD, NAD, NADP, CoA), grupy chemiczne (np. hem w cytochromach), jony (np. Fe, Cu, Zn, Co, Mg).
Enzymy, ze względu na typ reakcji, którą katalizują, dzielą się na kilka klas.
| Klasa enzymów | Działanie | Przykłady enzymów |
| Oksydoreduktazy | kataliza reakcji redox | dehydrogenazy,oksydazy |
| Transferazy | przenoszenie grup chemicznych zawierających np. węgiel, azot, fosfor | metylotransferazy, transaminazy, kinazy |
| Hydrolazy | kataliza reakcji rozpadu z udziałem wody, np. hydroliza wiązań estrowych, peptydowych, glikozydowych | pepsyna,amylaza, fosfatazy |
| Liazy | kataliza reakcji rozpadu, ale bez udziału wody | dekarboksylaza pirogronianowa |
| Izomerazy | kataliza przekształceń wewnątrzcząsteczkowych | izomeraza cytrynianowa |
| Ligazy (syntetazy) | wytwarzanie nowych wiązań kowalencyjnych | enzymy aktywizujące aminokwasy |
Enzymy działają w zespołach, uczestnicząc w łańcuchach reakcji zwanych szlakami biochemicznymi.

