Zachowanie się elektrolitów w roztworach wodnych opisuje teoria Arrheniusa, w myśl której elektrolity pod wpływem wody ulegają dysocjacji elektrolitycznej, czyli samorzutnemu rozpadowi na jony. Moc elektrolitów zależy od ich stopnia zdysocjowania w roztworze. Stopień dysocjacji określa liczbę cząsteczek zdysocjowanych w stosunku do całkowitej liczby cząsteczek elektrolitu (liczby cząsteczek wprowadzonych do roztworu).
Stopień dysocjacji określa,jaka część elektrolitu uległa dysocjacji:
Stopień dysocjacji zależy od rodzaju elektrolitu, rozpuszczalnika, temperatury (ze wzrostem na ogół nieco wzrasta), stężenia roztworu (wraz z rozcieńczaniem roztworu rośnie) i od obecności innych jonów w roztworze (np. wspólny jon powoduje zmniejszenie wartości stopnia).
Biorąc pod uwagę, w jakim stopniu elektrolity ulegają dysocjacji, można podzielić je na:
| Elektrolity mocne | Elektrolity słabe |
| praktycznie całkowicie zdysocjowane na jony: | tylko część ich cząsteczek ulega rozpadowi na jony: |
|
|
|
|
|
|
Należy pamiętać, że o przebiegu procesu dysocjacji decyduje rozpuszczalnik. Substancje, które w środowisku wodnym są elektrolitami mocnymi, w innych rozpuszczalnikach mogą być słabymi i odwrotnie.
Rozważmy proces autodysocjacji wody (słabego elektrolitu):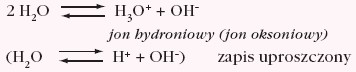
Stosując do tej równowagi prawo działania mas: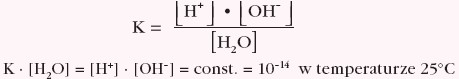
można wprowadzić pojęcie iloczynu jonowego wody jako iloczynu stężeń jonów wodorowych i wodorotlenkowych. Iloczyn ten jest wielkością stałą w danej temperaturze.
Iwody = [H+] · [OH–] = 10–14
Definiując kolejne pojęcia – pH i pOH:
pH = – log [H+] wielkość charakteryzująca odczyn roztworu
pOH = – log [OH–]
otrzymujemy zależność: pH + pOH = 14
| pH < 7 | pH = 7 | pH > 7 |
| roztwór o odczynie kwaśnym [H+] > [OH–] |
roztwór obojętny [H+] = [OH–] |
roztwór o odczynie zasadowym [H+] < [OH–] |
| kwasowość rośnie ze spadkiem wartości pH | pH = pOH | zasadowość rośnie ze wzrostem wartości pH |

