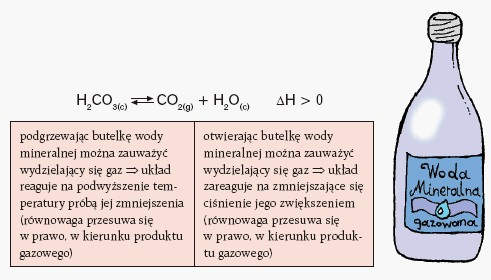
Jeżeli jeden z produktów reakcji chemicznej opuszcza układ reakcyjny np. w postaci gazu, to reakcja ta na pewno przebiega do końca w prawo, czyli do całkowitego wyczerpania substratów. Można ją określić jako praktycznie nie odwracalną. W równaniu reakcji ten fakt należy zaznaczyć jedną strzałką skierowaną w prawą stronę --> .
Większość reakcji chemicznych – w odpowiednich warunkach – przebiega w obu kierunkach,tzn. tworzą się produkty i jednocześnie zachodzi reakcja odwrotna, czyli utworzenie substratów z produktów. Jeżeli reakcja przebiega w układzie zamkniętymi jednorodnym (gazowym lub ciekłym) oraz nie następuje zmiana parametrów fizycznych układu dostatecznie długo, to ustala się stan równowagi dynamicznej. Ten stan charakteryzuje się tym, że stężenia reagentów w jednostce czasu nie ulegają zmianie (stężenia są stałe) pod warunkiem, że nie zmieniają się czynniki wpływające na szybkość reakcji, chociaż reakcje te zachodzą nadal. W równaniu reakcji ten fakt zaznaczyć należy dwiema strzałkami z tzw. półgrotami: ![]()
Analizujemy jednoetapową reakcję odwracalną przedstawioną w sposób ogólny poniższym schematem:
![]()
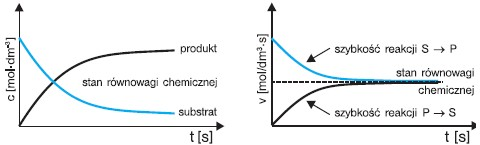
Reakcja biegnąca w prawo przebiega z szybkością v1 (stała szybkości k1), a reakcja przebiegająca w lewo – z szybkością v2 (stała szybkości k2). Po pewnym czasie ustala się stan równowagi, który scharakteryzować można zrównaniem szybkości reakcji (v1 = v2) oraz obecnością zarówno substratów, jak i produktów reakcji w określonych równowagowych stężeniach.
![]()
Uzyskany stan równowagi w układzie (skład układu równowagowego) można opisać w sposób matematyczny:
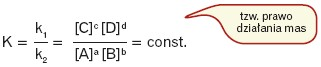
K to stała równowagi chemicznej (tu: ze względu na fakt, że jest zdefiniowana poprzez stężenia – tzw. stężeniowa stała równowagi chemicznej). Wielkość ta jest stała w danych warunkach temperaturowych i niezależna od wartości stężeń reagentów. Charakteryzuje skład mieszaniny reakcyjnej w stanie równowagi. Jest to wielkość bezwymiarowa, gdyż wartości stężeń równowagowych dzielone są przez tzw. stężenie standardowe wynoszące 1 mol/dm3 .
[A], [B], [C], [D] to równowagowe stężenia reagentów (w obliczeniach podawane jako bezwymiarowe), natomiast k1, k2 to stałe szybkości reakcji.
Stężenia substratów (S) i produktów (P) oraz szybkość reakcji biegnących w prawo(S --> P) i w lewo (P --> S) zmieniają się w miarę przebiegu reakcji w następujący sposób (jeśli k1 = k2):
Prawo działania mas: w stanie równowagi chemicznej stosunek iloczynu stężeń produktów podniesionych do odpowiednich potęg (odpowiadających współczynnikom stechiometrycznym) do iloczynu stężeń substratów podniesionych do odpowiednich potęg (odpowiadających współczynnikom stechiometrycznym) jest wielkością stałą w danej temperaturze (oraz ciśnienia w przypadku reakcji przebiegających w fazie gazowej ze zmianą objętości reagentów), charakterystyczną dla danej reakcji.

Jak obliczyć równowagowe stężenia reagentów?
Zakładamy, że:
- substraty zostały zmieszane w stosunku molowym 1:2,
- reakcja przebiega według równania: 2 A + B = A2B,
- stwierdzono obecność y moli produktu w stanie równowagi.
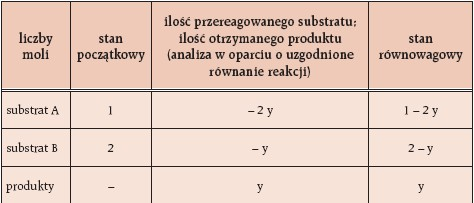
Można więc zapisać:
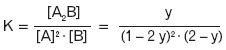
Wartość stałej równowagi K reakcji zależy od temperatury. W przypadku reakcji endotermicznej, wartość K wzrasta ze wzrostem temperatury, a w przypadku reakcji egzotermicznej – wartość K maleje ze wzrostem temperatury.
Na stan równowagi reakcji wpływa zmiana stężenia któregokolwiek z reagentów, zmiana ciśnienia (dla reakcji gazowych) oraz zmiana temperatury.
Reguła przekory (Le Chateliera i Brauna):
Jeżeli na układ będący w stanie równowagi dynamicznej zadziała jakiś czynnik zewnętrzny, który równowagę zaburzy, to w układzie zajdzie przemiana zmierzająca do zminimalizowania skutków działania tego czynnika i osiągnięcia nowego stanu równowagi.

Katalizator nie wpływa na położenie stanu równowagi, jedynie skraca czas potrzebny na osiągnięcie tego stanu.
Reguła przekory nie jest stosowana w przypadku, gdy:
- następuje zmiana ciśnienia, a w trakcie reakcji nie następuje zmiana objętości produktów i substratów,
- następuje zmiana temperatury, a reakcji nie towarzyszy żaden efekt cieplny.
Rozważmy przykład: