Szybkość reakcji chemicznej v można określić zmianą masy, stężenia lub objętości reagenta w jednostce czasu. Szybkość nie jest wielkością stałą, lecz w miarę postępu reakcji zmienia się.

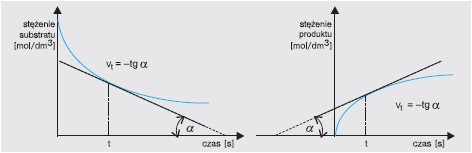
Szybkość reakcji w danej chwili t to pochodna stężenia substratu (lub produktu) po czasie (dc/dt). Wartość szybkości reakcji można wyznaczyć z kąta nachylenia do osi x stycznej do krzywej zmian stężenia substratu lub produktu. Ujemna wartość tangensa kąta nachylenia stycznej wyznacza szybkość reakcji w danej chwili:
Szybkość reakcji chemicznej zależy od wielu czynników. Przede wszystkim od:
- rodzaju i stężenia reagentów – zakładając, że reakcja przebiega bez etapów pośrednich, można w niektórych przypadkach przyjąć, że szybkość reakcji zależy wyłącznie od stężenia substratów i tylko w tych warunkach można napisać równanie kinetyczne wprost w oparciu o równanie reakcji:

Należy jednak pamiętać, że współczynników α, β w równaniu kinetycznym zazwyczaj nie należy utożsamiać z współczynnikami stechiometrycznymi, choć mogą się one im równać (co należy jednak do rzadkości i jest zdeterminowane warunkiem określonym powyżej).
- Stała szybkości reakcji jest wielkością stałą dla danej reakcji w określonej temperaturze; wartość stałej wyznaczana jest doświadczalnie; liczbowo jest równa szybkości reakcji, gdy stężenia reagentów wynoszą 1 mol/dm3.
- W równaniu kinetycznym występują chwilowe molowe stężenia substratów. Jeżeli np. objętość naczynia zmaleje dwa razy, wówczas wartości stężeń wzrosną dwukrotnie.
- Całkowity rząd reakcji, a zatem rzędy reakcji względem określonych substratów wyznaczane są doświadczalnie.
Biorąc pod uwagę fakty 1, 2 i 3 można stwierdzić:
Z racji doświadczalnego wyznaczania zarówno stałej szybkości reakcji, jak i rzędów reakcji względem określonych substratów, równanie kinetyczne jest równaniem empirycznym.
 Ważnym pojęciem w kinetyce jest tzw. cząsteczkowość (molekularność) reakcji. Z definicji jest to liczba cząsteczek (albo atomów, rodników, jonów) biorących udział w reakcji elementarnej (akcie elementarnym), postulowanym jako etap mechanizmu reakcji.
Ważnym pojęciem w kinetyce jest tzw. cząsteczkowość (molekularność) reakcji. Z definicji jest to liczba cząsteczek (albo atomów, rodników, jonów) biorących udział w reakcji elementarnej (akcie elementarnym), postulowanym jako etap mechanizmu reakcji.
Reakcje, których szybkość nie zależy od stężenia substratów, są nazywane reakcjami zerowego rzędu. Przykładem są niektóre reakcje fotochemiczne przebiegające pod wpływem światła.
Równanie stechiometryczne reakcji opisuje jedynie bilans molowy reagentów, a nie wyjaśnia rzeczywistego mechanizmu reakcji, czyli wszystkich przemian, jakie kolejno następują w trakcie przekształcania się substratów w produkty.
W przypadku reakcji wieloetapowych zazwyczaj każdy z etapów zachodzi z inną szybkością. Najpowolniejszy z nich, zwany etapem limitującym, decyduje o szybkości całego ciągu etapów. Substraty tego limitującego procesu pojawiają się w równaniu kinetycznym, co można wyznaczyć jedynie na drodze eksperymentalnej.
| równanie stechiometryczne | równanie kinetyczne | rząd reakcji | jednostka stałej szybkości |
| N2O5 --> 2 NO2 + ½ O2 | v = k [N2O5] | I | 1/s |
| H2 + I2 --> 2 HI | v = k [H2]·[I2] | II | dm3/(mol · s) |
| 2 NO + O2 2 NO2 | v = k [NO]2 [O2] | III | (dm3)2/(mol2 · s) |
Pamiętaj! Jednostka szybkości reakcji to: ![]()
- Temperatury – szybkość reakcji chemicznej rośnie na ogół wyraźnie ze wzrostem temperatury, poprzez wzrost wartości stałej szybkości reakcji:


