W temperaturze pokojowej azot jest bardzo mało reaktywny. Jego reaktywność można zwiększyć, ogrzewając go lub poddając wyładowaniom elektrycznym w warunkach niskiego ciśnienia.
Jeden z najbardziej znanych związków azotu to amoniak. Amoniak jest lekkim, bezbarwnym gazem o charakterystycznym zapachu, drażniącym błony śluzowe. Rozpuszcza się w wodzie, a powstały roztwór ma odczyn zasadowy:

Amoniak można otrzymać, działając mocną zasadą na sole amonowe w podwyższonej temperaturze:
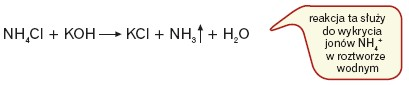
Można także poddać sole amonowe rozkładowi w podwyższonej temperaturze:
![]()
Nietrwałość soli amonowych wykorzystuje się np. w proszku do pieczenia, którego składnikiem jest wodorowęglan amonu:
![]()
Amoniak reaguje z chlorowodorem, tworząc białe dymy chlorku amonu:
![]()
Amoniak w tlenie spala się tworząc azot i wodę:
![]()
Produktem spalania amoniaku w tlenie w obecności katalizatora jest tlenek azotu(II):
![]()
| nazwa systematyczna | wzór | właściwości | otrzymywanie |
| tlenek azotu(I) | N2O | bezbarwny gaz o słodkawym zapachu i smaku, kiedyś stosowany jako środek znieczulający (gaz rozweselający) | NH4NO3 --> N2O + 2 H2O |
| tlenek azotu(II) | NO | bezbarwny trujący gaz; związek aktywny biologicznie – w niewielkich stężeniach odgrywa rolę przy przekazywaniu impulsów nerwowych | N2 + O2 łuk elektr. --> 2 NO 4 NH3 + 5 O2 --> 4 NO + 6 H2O |
| tlenek azotu(III) | N2O3 | niebieska ciecz, otrzymywana w trakcie oziębiania mieszaniny NO i NO2 | NO + NO2 oziębianie --> N2O3 |
| tlenek azotu(IV) | NO2 | NO2 jest brunatnym gazem o charakterystycznym zapachu; łatwo dimeryzuje tworząc N2O4 – bezbarwny gaz | 2 NO + O2 --> 2 NO2 2 NO2 <==> N2O4 |
| tlenek azotu(V) | N2O5 | bezbarwne ciało stałe, rozpuszczalne w wodzie | odwodnienie kwasu azotowego(V) 2 HNO3 --> N2O5 + H2O |
Rozcieńczony, a także stężony kwas azotowy(V) należy do kwasów silnie utleniających – reaguje zarówno z niemetalami, jak i metalami:
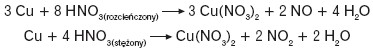
Niektóre metale, np. glin, żelazo, pod wpływem stężonego HNO3 ulegają pasywacji. Stężony kwas azotowy(V) niszczy barwniki i papier. Substancje białkowe pod wpływem jego działania przyjmują charakterystyczną żółtą barwę (reakcja ksantoproteinowa, nitrowanie reszt aminokwasów aromatycznych).

