to zapis przedstawiający przyporządkowanie elektronów atomu odpowiednim orbitalom atomowym. W stanie podstawowym (tzn. o minimalnej energii) przyporządkowanie to odbywa się zgodnie z następującymi regułami:
a) w atomach wieloelektronowych elektrony zapełniają orbitale atomowe według ich wzrastającej energii orbitalnej: 1s 2s 2p 3s 3p 4s 3d 4p 5s 4d 5p 6s 4f 5d 6p itd.;
b) zakaz Pauliego: w atomie wieloelektronowym dwa elektrony nie mogą znajdować się w stanach opisywanych takimi samymi wartościami wszystkich liczb kwantowych. Każdy elektron w atomie musi różnić się od pozostałych wartością co najmniej jednej liczby kwantowej. Jeden orbital może opisać stan dwóch elektronów,np. 1s2 – stan tych dwóch elektronów opisują następujące liczby kwantowe:
- n = 1, l = 0, m = 0, ms = ½, s = ½
- n = 1, l = 0, m = 0, ms = –½, s = ½
c) reguła Hunda: podczas zapełniania orbitali zdegenerowanych należy kierować się zasadą, aby liczba elektronów niesparowanych była jak największa. Elektrony niesparowane mają jednakowy kierunek spinu, np.:
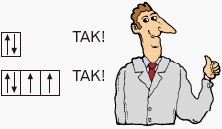 |
 |

