Związki chemiczne można podzielić na:
- elektrolity – związki, które w roztworach wodnych lub w stanie stopionym przewodzą prąd elektryczny,
- nieelektrolity – związki, które w roztworach wodnych nie przewodzą prądu elektrycznego.
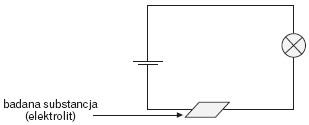
Elektrolity zaliczane są do tzw. przewodników jonowych, ponieważ w układzie obecne są swobodne jony będące nośnikami prądu elektrycznego. Jony pochodzą z procesu dysocjacji elektrolitycznej lub stopienia. Dysocjacji ulegają substancje, w których występuje wiązanie jonowe lub atomowe spolaryzowane. Doświadczalnie można potwierdzić przepływ prądu przez elektrolit, budując prosty układ elektryczny:
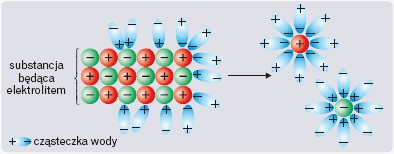
Zachowanie się elektrolitów w roztworach wodnych opisuje teoria Arrheniusa, w myśl której elektrolity pod wpływem wody ulegają dysocjacji elektrolitycznej, czyli samorzutnemu rozpadowi na jony.
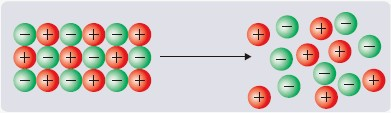
Substancje o budowie jonowej podczas stapiania w wysokiej temperaturze również tworzą swobodne jony, czyli nośniki ładunku:
Stopień dysocjacji α określa liczbę cząsteczek zdysocjowanych w stosunku do całkowitej liczby cząsteczek elektrolitu (liczby cząsteczek wprowadzonych do roztworu). Stopień dysocjacji α określa, jaka część elektrolitu uległa dysocjacji:
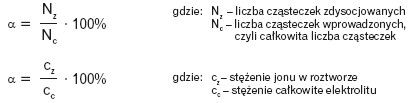
0 < α 1 lub 0% < α 100%
Stopień dysocjacji zależy od rodzaju elektrolitu, rozpuszczalnika, temperatury (ze wzrostem na ogół nieco wzrasta), stężenia roztworu (wraz z rozcieńczaniem roztworu rośnie) i od obecności innych substancji w roztworze (np. wspólny jon powoduje zmniejszenie wartości α).
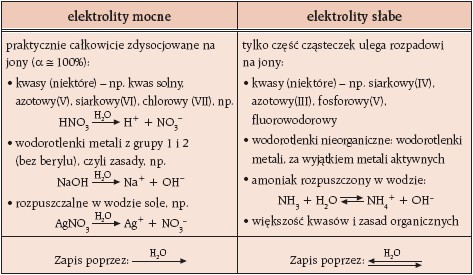
Biorąc pod uwagę, w jakim stopniu elektrolity ulegają dysocjacji, można podzielić jena mocne i słabe: