W przypadku elektrolitów słabych w roztworach wodnych ustala się równowaga pomiędzy cząsteczkami zdysocjowanymi i niezdysocjowanymi (poniżej zapis w formie uproszczonej).

Wartości Ka i Kb w obliczeniach podaje się bez jednostki!
Wartość stałej dysocjacji zależy tylko od temperatury, a nie zależy od stężenia elektrolitu. Im większa wartość stałej dysocjacji, tym mocniejszy kwas lub zasada.
Prawo rozcieńczeń Ostwalda przedstawia matematyczną zależność pomiędzy stałą dysocjacji elektrolitu a jego stopniem dysocjacji w roztworze o stężeniu całkowitym c:
![]()
W przypadku, gdy stopień dysocjacji jest bardzo mały ![]() można stosować jego formę uproszczoną w postaci:
można stosować jego formę uproszczoną w postaci:

Dla kwasów dysocjujących wielostopniowo stwierdzono, że stała dysocjacji pierwszego stopnia jest największa, a wartości kolejnych stałych dysocjacji są coraz mniejsze, np.:
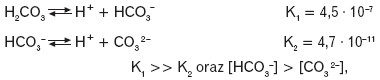
a dla reakcji zapisanej sumarycznie obowiązuje zależność:
![]()
Można to potwierdzić następująco:
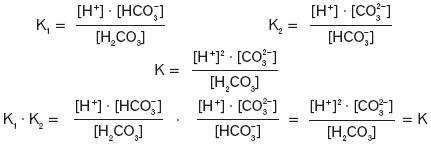
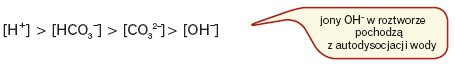
Poniższy szereg obrazuje zmiany wartości stężeń molowych jonów obecnych w roztworze: