Mieszanina - powstaje po wymieszaniu ze sobą co najmniej 2 składników.
Mieszanina jednorodna - to mieszanina której składników nie jesteśmy w stanie rozróżnić gołym okiem ani za pomocą prostych przyrządów optycznych.
Mieszanina niejednorodna - mieszanina, której składniki możemy zobaczyć gołym okiem lub za pomocą prostych przyrządów optycznych
Metody rozdzielania mieszanin jednorodnych: odparowanie, krystalizacja, destylacja
Krystalizacja - polega na wydzielaniu się substancji w postaci kryształków z roztworu wskutek np. odparowania roztworu
Destylacja - polega na rozdzieleniu składników, wykorzystując różnice w temperaturach ich wrzenia. Ciekłą mieszaninę jednorodną umieszcza się w kolbie destylacyjnej podłączonej do chłodnicy. Mieszaninę ogrzewa się, kontrolując na termometrze jej temperaturę. Składniki mieszaniny kolejno skraplają się w chłodnicy i ściekają do podstawowego naczynia.
Metody rozdzielania mieszanin niejednorodnych: sedymentacja, dekantacja, sączenie, mechanicznie, rozdzielacz, magnez, laska ebonitowa
Sedymentacja - to opadanie na dno naczynia cząsteczek ciała stałego pod wpływem siły ciężkości
Dekantacja - polega na oddzieleniu ciała stałego od cieczy przez zlanie klarownej cieczy znad osadu.
Sączenie (filtracja) - polega na przelewaniu mieszaniny cieczy z ciałem stałym przez sączek z bibuły umieszczony na lejku.
Reakcja chemiczna - to przemiana chemiczna w wyniku której powstaje zupełnie nowa substancja o zupełnie nowych właściwościach.
Zjawisko fizyczne - to przemiana w wyniku której nie powstaje żadna nowa substancja.
Pierwiastek - substancja prosta, której nie można rozłożyć na prostsze.
Związek chemiczny - to substancja złożona z co najmniej 2 różnych pierwiastków połączonych ze sobą trwale.
Antonine Lavoisier odkrył powietrze.
Reakcja syntezy (łączenia) - reakcja chemiczna, podczas której z kilku substratów powstaje jeden produkt
Substraty - substancje wzięte do reakcji i ulegające przemianom chemicznym.
Produkty - substancje powstające w wyniku reakcji chemicznych.
Reagenty - substraty i produkty reakcji.
Reakcja analizy (rozkładu) - reakcja podczas której z jednego substratu powstaje kilka produktów.
Utlenianie - reakcja chemiczna zachodząca pomiędzy tlenem i innym pierwiastkiem-tworzenie tlenków.
Spalanie - to gwałtowne utlenianie, któremu towarzyszy ciepło i światło.
Z azotu otrzymuje się amoniak.
Reakcja wymiany - reakcja chemiczna, podczas której z kilku substratów powstaje kilka produktów.
Higroskopijność - zjawisko pochłaniania pary wodnej przez pewne substancje.
Reakcje endoenergetyczne - reakcje chemiczne do których przebiegu konieczne jest stałe doprowadzanie energii.
Reakcje egzoenergetyczne - reakcje chemiczne przebiegające z wydzieleniem energii.
Reakcja redox = utlenianie + redukcja
Redukcja - odłączanie tlenu
Reduktor - substancja, która przyłącza tlen
Dyfuzja - zjawisko samorzutnego mieszania się cząsteczek stykających się substancji
TEORIA DALTONA
1. Atomy mają kształt kulisty
2. Atomy tego samego pierwiastka są identyczne pod względem masy i rozmiarów
3. Atom jest najmniejszą cząstką pierwiastka, która posiada wszystkie cechy tego pierwiastka
4. Atomy łączą się, tworząc cząsteczki
5. Związek chemiczny jest zbiorem tych samych cząsteczek
Masa atomowa - masa atomu wyrażona w atomowych jednostkach masy-1u
Prawo zachowania masy - masa substratów, jest równa masie produktów
Budowa atomu - jądro, neutrony, protony, elektrony
Atom - układ złożony z jadra atomowego i poruszających się wokół jądra elektronów tworzących powłoki elektronowe
Jądro - najbardziej wewnętrzna, dodatnio naładowana część atomu, zawierająca protony i neutrony zwane łącznie nukleonami
Proton - cząstka podstawowa, składnik jądra atomowego, o masie równej 1u i ładunku elektrycznym równym jednemu elementarnemu ładunkowi dodatniemu
Neutron - cząstka podstawowa, składnik jądra atomowego, o masie równej 1u i nie mające ładunku elektrycznego
Powłoka elektronowa - (poziom energii) tworzą ją poruszające się w różnej odległości od jądra elektrony
Elektron - cząstka podstawowa, poruszająca się wokół jądra atomowego, mająca ładunek elektryczny równy jednemu elementarnemu ładunkowi ujemnemu i masie równej 1/1840 u.
Rdzeń atomowy - jadro z elektronami znajdującymi się na wewnętrznych powłokach elektronowych
Numer grupy - ilość elektronów walencyjnych
Numer okresu - ilość powłok elektronowych
Z - liczba atomowa = ilość protonów, liczba elektronów, ładunek jądra
A - masa atomowa = masa protonów i neuronów
Izotopy - atomy tego samego pierwiastka różniące się między sobą liczbą neutronów w jądrze
Okres połowicznego rozpadu (zaniku) - okres pół trwania. Jest to czas po upływie którego w próbce pierwiastka połowa atomów ulega rozpadowi
Wiązanie kowalencyjne niezpolaryzowane - występuje pomiędzy atomami tego samego pierwiastka (niemetali) dając cząsteczki homojądrowe np. H2,O2
Wiązanie kowalencyjne zpolaryzowane - występuje pomiędzy atomami różnych pierwiastków(niemetali) dając cząsteczki heterojądrowe
Dipol - cząsteczka dwubiegunowa tworząca układ polarny - biegun dodatni (+) i biegun ujemny (-)
Wiązanie jonowe - występuje pomiędzy metalami i niemetalami (1 i 2 grupa, 16 i 17 grupa)
Jony - atomy obdarzone ładunkiem elektrycznym dodatnim lub ujemnym
Kationy - jony dodatnie
Aniony - jony ujemne
Wartościowość (od numeru grupy) - liczba wiązań za pomocą których atomy łączą się ze sobą (wiązanie kowalencyjne), lub ładunek jodu (wiązanie jonowe) Wartościowość związana jest z liczbą elektronów walencyjnych
Wzór sumaryczny - wzór uwzględniający tylko rodzaje i liczbę atomów
Wzór strukturalny - wzór uwzględniający rodzaj i liczbę atomów oraz liczbę wiązań.
O2 H2 N2 Cl2 Br2 I2 F2
W wodzie dobrze rozpuszczają się substancje o budowie polarnej.
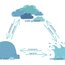
Stany skupienia wody:
Lód --> topnienie --> Ciekła woda --> krzepnięcie --> lód
Ciekła woda --> skraplanie --> Para wodna --> parowanie--> Ciekła woda
Para wodna --> resublimacja --> lód --> sublimacja--> Łód
Szybkość rozpuszczania się substancji zależy od:
- temperatury
- mieszania
- rozdrobnienia substancji rozpuszczanej
Podział roztworu ze względu na
- ilość substancji rozpuszczonej: roztwór nasycony i nienasycony(rozcieńczony, stężony)
- wielkość cząsteczek substancji rozpuszczanej roztwór właściwy, koloid, zawiesina
Roztwór nasycony - roztwór, w którym w danej temperaturze nie można rozpuścić więcej danej substancji
Roztwór nienasycony - roztwór, w którym w danej temperaturze można rozpuścić pewną ilość danej substancji
Roztwór właściwy - roztwór którego cząstki są niezauważalne.
Roztwór koloidalny - roztwór w którym cząsteczki mogą być zauważalne
Zawiesina - mieszanina cieczy i ciała stałego, której cząstki są wyraźnie zauważalne
Rozpuszczalność substancji - to max. liczba gramów substancji, którą można rozpuścić w 100 gramach rozpuszczalnika w danej temperaturze aby otrzymać roztwór nasycony
Rozpuszczalność substancji zależy od:
- temperatury
- rodzaju substancji
- rozpuszczalnika
Stężenie procentowe roztworu - jest to liczba gramów substancji rozpuszczonej w 100 gramach roztworu.
C% = Ms * 100% / Mr
Mr = masa roztworu = M substancji + M rozpuszczalnika
Praca sporządzona na podstawie notatek z zeszytu, również w załączniku wraz z rysunkiem budowy atomu oraz schematem zmian stanów wody.
Opracowania powiązane z tekstem
Treść zweryfikowana i sprawdzona
Zgodnie z misją, Redakcja serwisu dokłada wszelkich starań, aby dostarczać rzetelne i sprawdzone treści edukacyjne.
Dodatkowe oznaczenie "Sprawdzona treść" wskazuje, że dany materiał został zweryfikowany przez Redakcję lub ekspertów współpracujących z serwisem.
Weryfikacja tekstu odbywa się na następujących poziomach:
1. Sprawdzenie tekstu pod kątem ewentualnych błędów ortograficznych, stylistycznych, interpunkcyjnych lub innych.
2. Weryfikacja tekstu pod kątem błędów rzeczowych.
3. Sprawdzenie materiału pod kątem ich aktualności.
Dodatkowe oznaczenie "Sprawdzona treść" wskazuje, że dany materiał został zweryfikowany przez Redakcję lub ekspertów współpracujących z serwisem.
Weryfikacja tekstu odbywa się na następujących poziomach:
1. Sprawdzenie tekstu pod kątem ewentualnych błędów ortograficznych, stylistycznych, interpunkcyjnych lub innych.
2. Weryfikacja tekstu pod kątem błędów rzeczowych.
3. Sprawdzenie materiału pod kątem ich aktualności.