Równanie to wiąże ze sobą parametry stanu dla n moli gazu doskonałego. Jest to równanie stanu gazu, które ma postać:
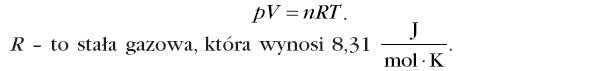
Przykład:
Oblicz temperaturę 1 mola tlenu wiedząc, że znajduje się on pod ciśnieniem atmosferycznym (1013 hPa) i zajmuje objętość 0,0224 m3.
Rozwiązanie:
Tlen w takich warunkach możemy traktować jako gaz doskonały. Korzystamy więc z równania Clapeyrona: pV = nRT,
wypisujemy dane: n=1 mol, p=1013hPa = 1013⋅102 Pa,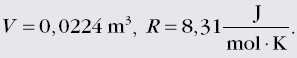
Przekształcamy równanie Clapeyrona: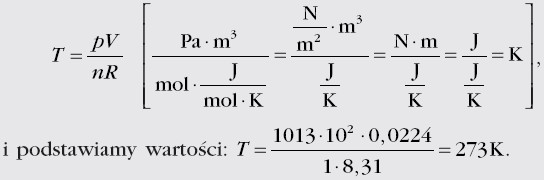
1 mol tlenu pod ciśnieniem 1013 hPa, o objętości 0,0224 m3 ma temperaturę 273 K czyli 0°C. Warunki określone przez takie ciśnienie i temperaturę nazywamy warunkami normalnymi. Jeden mol dowolnego gazu w warunkach normalnych zajmuje objętość 0,0224 m3.

