Sa to związki zawierające grupę hydroksylową –OH bezpośrednio związaną z atomem węgla w pierścieniu aromatycznym. Najprostszym przedstawicielem tej grupy jest benzenol (hydroksybenzen), zwany fenolem, o wzorze C6H5–OH
![]()
Fenol otrzymujemy w reakcji opisanej poniższymi równaniami:
C6H5-Cl + 2 NaOH → C6H5-ONa + NaCl + H2O
C6H5ONa + HCl → C6H5-OH + NaCl
Fenol wykazuje wyraźny charakter kwasowy. W roztworze wodnym dysocjuje jak kwas, czyli odszczepia kation wodoru H+ (uproszczony zapis):
![]()
Zaliczany jest do słabych kwasów. Kwas węglowy jako mocniejszy kwas wypiera słabszy fenol z jego soli, np.
C6H5ONa + CO2 + H2O → C6H5OH + NaHCO3
Fenol reaguje z metalami aktywnymi (litowce) i mocnymi zasadami, np.
C6H5OH + Na → C6H5ONa + 1/2 H2
C6H5OH + KOH → C6H5OK + H2O
Fenolan potasu jako sól słabego kwasu i mocnej zasady ulega hydrolizie anionowej. Wodny roztwór tego związku posiada odczyn zasadowy, co potwierdza jonowy zapis tego procesu:
![]()
Reakcją charakterystyczną fenoli jest reakcja z solami żelaza(III) – obserwuje się fioletowe (lub granatowe) zabarwienie roztworu. Fenol jest związkiem aromatycznym i stąd ulega również reakcjom charakterystycznym dla tych związków, np. bromowaniu i nitrowaniu. Reakcje te zachodzą dużo łatwiej niż w przypadku benzenu:
- bromowanie (bez katalizatora) – powstaje 2,4,6-tribromofenol
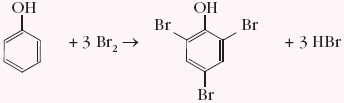
- nitrowanie (rozcieńczony HNO3) – powstaje mieszanina o-nitrofenolu i p-nitrofenolu
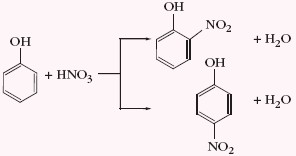
Grupa –OH w cząsteczce fenolu, jako podstawnik I rodzaju, kieruje następny podstawnik w pozycje orto i para.
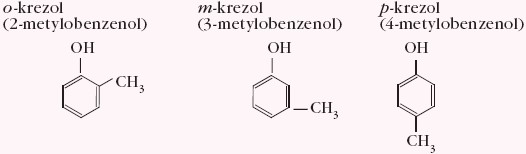
Przykładowe inne fenole, np. metylowe pochodne fenolu, czyli krezole:
Fenole będące pochodnymi naftalenu to naftole:


