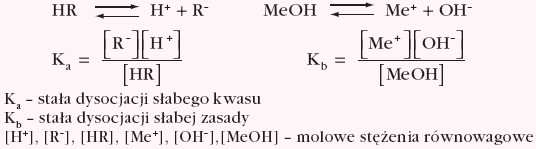Są to związki typu słabych kwasów lub słabych zasad organicznych. Barwa ich formy zdysocjowanej, jak i niezdysocjowanej jest różna. pH roztworu decyduje, która z tych form będzie w przewadze i która barwa się pojawi. W roztworze ustala się stan równowagi, którego położenie zależy od stężenia jonów H+ lub OH–:
![]()
np. w środowisku zasadowym jony OH– spowodują przesunięcie równowagi na prawo, co wywoła zmianę barwy. Wskaźnikiem jest np. fenoloftaleina, która przyjmuje barwę malinową w środowisku zasadowym (pH > 9) i oranż metylowy, który przyjmuje barwę czerwoną w środowisku kwaśnym (pH < 3,5).
Dla elektrolitów słabych w roztworach wodnych ustala się równowaga pomiędzy cząsteczkami zdysocjowanymi i niezdysocjowanymi – zapis w formie uproszczonej: