O zasadowym charakterze amin decyduje atom azotu, który mając wolną parę elektronową zdolny jest do przyłączenia jonów H+. Oznacza to, że aminy rozpuszczają się w wodzie (tworząc roztwór o odczynie zasadowym) i reagują z kwasami:
![]()
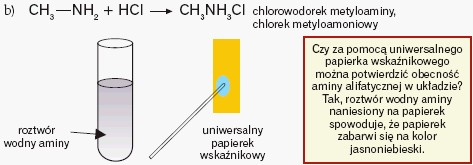
Aminy alifatyczne są silniejszymi zasadami od amoniaku. Ich zasadowość ze wzrostem rzędowości rośnie. Zwiększona w porównaniu z amoniakiem zasadowość jest skutkiem efektu indukcyjnego grup alkilowych, które odpychają elektrony w kierunku atomu azotu. Należy pamiętać, że każdy czynnik (podstawniki, elektroujemne atomy itp.) „angażujący”wolną parę elektronową atomu azotu będzie osłabiać zasadowość związku, a każdy czynnik „dopychający” elektrony w kierunku atomu azotu – zwiększać zasadowość:
Aminy jako słabe zasady mogą być wyparte ze swoich soli działaniem mocnych zasad, np.:
![]()
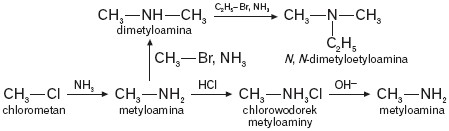
Poniżej podano schemat przemian chemicznych, w których uczestniczą aminy.
Trzeciorzędowe aminy mają zdolność reagowania z halogenkami alkilowymi i tworzenia czwartorzędowych soli amoniowych. Sole te można potraktować częściowo jako pochodne soli amonowych, w których każdy atom wodoru w jonie amonowym został zastąpiony grupą węglowodorową:
![]()
Czwartorzędowe sole amoniowe odgrywają ważną rolę biologiczną, są to np. cholina, acetylocholina.

