Każdej przemianie chemicznej towarzyszy określony efekt cieplny. Efekt cieplny można określić jako ilość energii wymienionej w postaci ciepła między układem a otoczeniem.
W przemianie izochorycznej (tzn. zachodzącej w stałej objętości) i przemianie izobarycznej (tzn. zachodzącej pod stałym ciśnieniem) efekt cieplny jest równy zmianie funkcji stanu (odpowiednio energii wewnętrznej reakcji i entalpii reakcji). Efekt cieplny jest więc niezależny od „drogi” przemiany, a jedynie od parametrów stanu początkowego i końcowego układu, gdyż zarówno energia wewnętrzna, jak i entalpia są funkcjami stanu.
przemiana izochoryczna: Q(v) = ΔU przemiana izobaryczna: Q(p) = ΔH
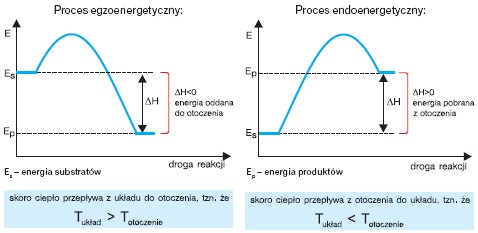
W przemianie izotermiczno-izobarycznej efekt cieplny jest równy zmianie entalpii układu ΔH (ΔH = H2 – H1). Entalpię reakcji podaje się w kJ/mol. Umownie przyjęto,że gdy ΔH < 0, czyli (H2 – H1) < 0, to przemianie towarzyszy przepływ energii (ciepła)od reagentów do otoczenia – proces egzoenergetyczny (egzotermiczny), a gdyΔH > 0, czyli (H2 – H1) > 0, to energia (ciepło) z otoczenia jest pochłaniana przez reagenty – proces endoenergetyczny (endotermiczny):
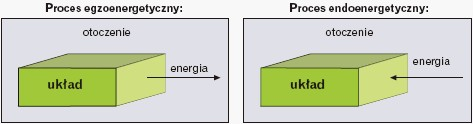
Zmiany entalpii podczas reakcji egzoenergetycznych i endoenergetycznych przedstawiają poniższe wykresy.
Efekt cieplny przemiany zależy od temperatury i ciśnienia. Jako indywidualna cecha przemiany zależy również od ilości reagentów i stanu ich skupienia. Pisząc równanie danej przemiany, należy podać stany skupienia wszystkich reagentów, ich odmianę krystalograficzną (i alotropową) oraz efekt cieplny, np.:
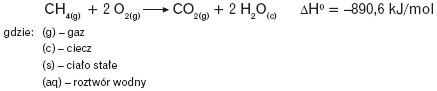
W tablicach termochemicznych podaje się zwykle standardowe efekty cieplne ΔH0 reakcji, czyli dla warunków określonych temperaturą 25°C czyli 298,15 K i ciśnieniem 105 Pa (zgodnie z zaleceniem IUPAC).

