Układ to część przestrzeni. Faza to jednolita fizycznie część układu.
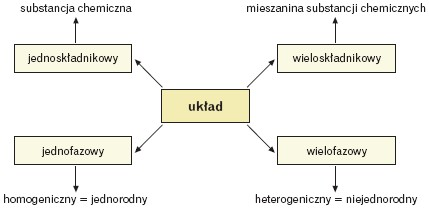
Układ to część przestrzeni. Faza to jednolita fizycznie część układu.

Układ dyspersyjny jest co najmniej dwuskładnikowym układem złożonym z fazy dyspersyjnej (rozpraszającej), zwanej często ośrodkiem, i z fazy zdyspergowanej (rozproszonej), którą określa się mianem substancji rozproszonej. przykład układu ośrodek dyspersyjny substancja zdyspergowana szkło ciało stałe ciało stałe powietrze gaz ciecz i ciało stałe dezodorant gaz ciecz dym gaz ciało stałe woda mineralna...
Biorąc pod uwagę średnicę cząstek fazy rozproszonej, układy dyspersyjne dzielimy na: roztwory właściwe układy koloidalne układy gruboziarniste, np. zawiesiny - średnica cząsteczek fazy rozproszonej:10 –9 – 10 –10 m - charakterystyka: układ homogeniczny (jednofazowy) wieloskładnikowy o rozdrobnieniu molekularnym (optycznie jednorodny) - średnica cząsteczek fazy rozproszonej: 10 –7 – 10 –9 m - charakterystyka: układ heterogeniczny (niejednorodny) Inne...
Liofilowe cząstki koloidalne w roztworze są otoczone przez cząsteczki rozpuszczalnika stanowiące tzw. otoczkę solwatacyjną. W przypadku, gdy rozpuszczalnikiem jest woda, otoczka nosi nazwę „hydratacyjna”, a cząstki posiadają właściwości hydrofilowe. W czasie procesu zwanego koagulacją część cząstek traci swoją otoczkę utworzoną z rozpuszczalnika i grupuje się w większe agregaty. Typową cechą roztworów koloidalnych jest tzw. efekt Tyndalla . Światło przechodząc przez roztwór...
Stężenie roztworu to stosunek ilości substancji rozpuszczonej do określonej ilości (objętości lub masy) roztworu. Stężenie procentowe C p wyraża liczbę gramów substancji rozpuszczonej znajdującej się w 100 gramach roztworu: Stężenie molowe C m określa liczbę moli substancji rozpuszczonej w 1 dm 3 (1000 cm 3 )roztworu. Jednostką stężenia molowego jest mol/dm 3 . Stężenie procentowe można łatwo przeliczyć na stężenie molowe (i odwrotnie), jeśli zna się wartość...
Roztwór wrze w temperaturze wyższej (efekt ebulioskopowy) od temperatury wrzenia czystego rozpuszczalnika, a krzepnie w temperaturze niższej (efekt krioskopowy) od temperatury krzepnięcia czystego rozpuszczalnika. Podwyższenie (obniżenie) temperatury jest tym większe, im większe jest stężenie wszystkich form (cząsteczek, jonów) substancji rozpuszczonej w roztworze. Najniższa temperatura krzepnięcia: roztwór NaCl. Najwyższa temperatura wrzenia: roztwór NaCl.
Materiał opracowany przez eksperta