Sód i potas reagując z tlenem tworzą nadtlenek sodu i odpowiednio ponadtlenek potasu:
![]()
Nadtlenek sodu reaguje z metalicznym sodem, tworząc tlenek sodu. Reaguje również z tlenkiem węgla(IV):
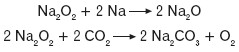
Ponadtlenek potasu reaguje z potasem, tworząc kolejno nadtlenek i tlenek potasu:
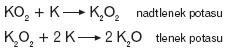
Lit jest miękkim, srebrzystoszarym metalem, który reagując z tlenem tworzy – jako jedyny litowiec – tlenek litu:
![]()
Tlenki litowców mają charakter zasadowy. Reagują z kwasami, a w reakcji z wodą tworzą odpowiednie zasady.
Sód i potas reagują z wodą. Reakcje te są egzoenergetyczne i w przypadku potasu reakcja przebiega gwałtowniej:
![]()
Otrzymujemy w obu przypadkach mocne zasady.
| związek | właściwości fizyczne | zastosowanie |
| NaOH wodorotlenek sodu (soda żrąca, soda kaustyczna) |
biała krystaliczna substancja dobrze rozpuszczalna w wodzie, zwykle formowana w granulki, które są higroskopijne i rozpuszczają się na powietrzu; wodorotlenek sodu jest substancją żrącą – parzy skórę | stosowany do produkcji mydeł i detergentów, barwników i szkła, a także produkcji papieru; wchodzi w skład środków do udrażniania rur i przewodów kanalizacyjnych |
| KOH wodorotlenek potasu (potas żrący) |
biała higroskopijna substancja, dobrze rozpuszczalna w wodzie, występuje w postaci granulek; łatwo chłonie CO2 z powietrza; jest silnie żrąca | stosowany do produkcji mydeł i barwników, a także jako pochłaniacz tlenku węgla(IV) |
Litowce reagują z wodorem, tworząc odpowiednie wodorki o charakterze zasadowym:
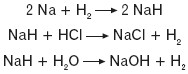
Wodorki litowców są ciałami stałymi.
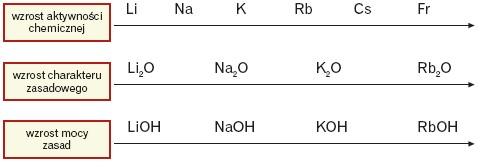
W grupie litowców ze wzrostem liczby atomowej wzrasta aktywność litowca, charakter zasadowy tlenków oraz moc zasad.